V. Equilibrio químico
EBAU:
· Matriz
de especificaciones
· Modelo
de examen
1. Un compuesto orgánico contiene C, H y O.
Cuando se produce la combustión completa, con oxígeno, de 28,2 g
del compuesto orgánico, se producen 40,5 g de CO2 y 16,7
g de H2O.
a) Determinar la fórmula empírica y
molecular del compuesto orgánico, sabiendo que dicha sustancia en
estado gaseoso tiene una densidad de 2,4 g·L-1 a una
presión de 750 mm Hg y a 27 ºC de temperatura.
b) Proponer dos
compuestos posibles con esta fórmula molecular, indicando sus
nombres.
Masas atómicas (u): H=1, C=12, O=16. R=0,082
atm·L·mol-1·K-1.
2. Modelos atómicos.
3. Justificar si los siguientes grupos de tres números cuánticos n, l y ml respectivamente, son o no permitidos. En caso afirmativo, indicar a qué tipo de orbital corresponde según los valores de n y l: a) 4, 2, -2; b) 3, 1, 0; c) 3, 1, 2; d) 3, 2, -1; e) 2, 1, 0.
4. Para los elementos Zn, Fe, P, Cl y Rb.
a)
Escribe la configuración electrónica y señala su periodo y grupo
en la tabla periódica.
b) Deduce razonadamente el estado de
oxidación de sus iones más estables.
c) Deduce las covalencias
que pueden presentar el Cl y el P.
d) Ordénalos de mayor a
menor afinidad electrónica.
e) Ordénalos de mayor a menor
radio atómico.
Datos: Números atómicos: P=15, Cl=17, Fe=26,
Zn=30, Rb=37.
5. Realiza un diagrama del Ciclo de Born-Haber para el K2O indicando las entalpías correspondientes a cada reacción y relacionándolas.
6. Para las moléculas BF3, CHF3
y C2H2 (etino):
a) Escribir sus
estructuras de Lewis.
b) Establecer su geometría molecular,
indicando la hibridación del átomo central.
c) Justificar la
polaridad de ambas moléculas.
Números atómicos (Z): H=1, B=5,
C=6, F=9.
7. Para las siguientes especies químicas: 1)
cloruro sódico (NaCl); 2) dióxido de carbono (CO2); 2)
dióxido de silicio (SiO2); 3) hielo y 4) aluminio.
a)
Explicar razonadamente qué tipo de enlace químico debe romperse o
qué tipo de fuerza intermolecular hay que vencer para fundirlas.
b)
Indica sus propiedades.
8. Contesta razonadamente:
a) ¿Cómo se
explica que la comida bien masticada facilite la digestión?
b)
¿Qué procedimiento se podría seguir para disminuir bruscamente la
velocidad de una reacción realizada en disolución acuosa?
c)
¿Por qué las limaduras de hierro se oxidan más rápidamente que
una llave de hierro con la misma masa?
d) ¿Cuáles son las
unidades en las que vendrá dada la constante de velocidad para una
reacción a) de primer orden, b) de segundo orden y c) de tercer
orden, cuando las concentraciones se expresan en mol·L–1?
e)
Expresa la relación entre las velocidades de cambio de productos y
reactivos para la reacción N2 (g) + 3H2 (g) →
2NH3 (g).
9. El peróxido de hidrógeno (H2O2),
llamado también agua oxigenada, se descompone muy lentamente en
disolución acuosa en oxígeno y agua. La reacción de descomposición
se ve facilitada cuando se añaden iones yoduro, y sigue el siguiente
mecanismo:
Etapa 1: H2O2 (ac) + I−
(ac) → H2O (l) + IO− (ac)
Etapa 2:
H2O2 (ac) + IO− (ac) → H2O
(l) + O2 (g) + I− (ac)
Cuando se estudia
experimentalmente este mecanismo se encuentra que la etapa 1 es la
más lenta.
a) Suponiendo que las etapas son elementales, escribe la ecuación de velocidad de la reacción
de descomposición del peróxido de hidrógeno en presencia de iones
yoduro e indique cuál es el orden total de la reacción.
b)
¿Con qué unidades se expresa la constante de velocidad de esta
reacción?
c) Explica razonadamente qué función tienen los
iones hipoyodito y yoduro en este proceso de descomposición.
d)
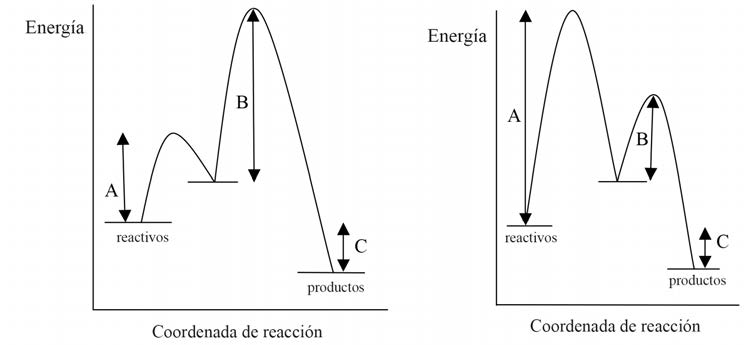
¿Cuál de las dos figuras siguientes representa mejor la
descomposición del peróxido de hidrógeno en presencia de iones
yoduro y qué magnitudes representan las letras A, B y C? Desde el
punto de vista energético, ¿la descomposición es exotérmica o
endotérmica? Argumenta las respuestas.

10. A 425 °C, el equilibrio: I2(g) +
H2(g) ⇄ 2HI(g) tiene una KC = 54,8.
a)
Deducir razonadamente en qué sentido se desplazará la reacción si,
en un recipiente de 10,00 L, se introducen 12,69 g de I2,
0,100 g de H2 y 25,58 g de HI y se calientan a 425 °C.
b)
Calcular las concentraciones de las tres especies en el
equilibrio.
c) Calcular sus presiones parciales en el
equilibrio.
d) Calcular el valor de KP.
Masas
atómicas (u): H=1,0; I=126,9. R = 0,082 atm·L·K-1·mol-1.
11. En un recipiente de medio litro se ponen 0,2
moles de A(g) y cuando la temperatura alcanza 180 °C se establece e1
equilibrio siguiente: A(g) ⇆ B(g) + C(g), con ΔH0= -190
kJ·mol–1.
a) Determinar KC y KP,
si su grado de disociación es 25 %.
b) Indicar dos formas de
aumentar el grado de disociación.
Dato: R = 0,082
atm·L·K-1·mol-1.
12. A 25 ºC la solubilidad del cloruro de plata
(AgCl) en agua es 1,88·10−3 g·L-1.
a)
Determinar el producto de solubilidad del cloruro de plata a 25
ºC.
b) Calcular la solubilidad (en g·L-1) del
cloruro de plata en presencia de una disolución 0,01 mol·L-1
de cloruro sódico (NaCl).
Masas atómicas (u): Cl=35,5,
Ag=107,9.
13. Se mezclan 50 mL de una disolución que
contiene 0,331 g de nitrato de plomo (II) (Pb(NO3)2)
con 50 mL de una disolución que contiene 0,332 g de yoduro potásico
(KI). Calcular:
a) Si se formará precipitado de yoduro de plomo
(II) (PbI2).
b) Solubilidad (en g·L-1),
del yoduro de plomo (II).
Datos: Considerar aditivos los
volúmenes. Masas atómicas (u): N=14,0; O=16,0; K=39,0; I=126,9;
Pb=207,0. KPs(PbI2) = 10−8.
14. Mediante la teoría de Brönsted-Lowry, justificar el carácter ácido, base o anfótero de las disoluciones acuosas de: a) CO32-; b) H2PO4–; c) HS–; d) NH4+.
15. A 25 ºC, la constante de disociación del
ácido acético (ácido etanoico) (CH3COOH) es 1,78·10-5.
Se tiene una disolución 0,25 M de ácido acético.
a)
Determina el grado de disociación y el pH de la disolución.
b) Calcula la
concentración de una disolución de ácido nítrico -trioxonitrato
(V) de hidrógeno- (ácido fuerte, HNO3) que tenga el
mismo pH que la disolución de ácido acético.
c) Describe el
procedimiento y el material necesario para preparar 100 mL de
disolución de HNO3 10-4 M a partir de la
anterior disolución.
16. La acción del H2SO4
concentrado sobre NaCl conduce a la obtención de HCl gaseoso y
Na2SO4. El HCl(g) liberado se recoge sobre agua
de forma que se obtiene un litro de disolución cuyo pH es 1.
a)
¿Qué cantidad de NaCl habrá reaccionado?
b) ¿Qué volumen de
H2SO4 de1 98% en peso y 1,84 g/cm3
de densidad debe emplearse en la reacción?
Masas atómicas:
Na=23,0 H=1,0 Cl=35,5 S=32,0 O=16,0.
17. Razonar si las disoluciones acuosas de las
siguientes sales serán ácidas, básicas o neutras: KCl, Na2CO3,
Na2S y NH4Br.
Datos: Ka(H2CO3)
= 4,7·10-11; Ka(H2S) = 1,0·10-19;
Kb(NH3) = 1,3·10-5.
18. Para intentar neutralizar 250 mL de HNO3
0,5 M se han añadido 150 mL de una disolución de NaOH 1 M.
a)
¿Se ha conseguido neutralizar la disolución? Justificar la
respuesta.
b) Calcular el pH de la disolución final resultante.
19. Calcular:
a) la cantidad (en gramos) de
NaOH necesaria para obtener 250 ml de disolución de pH=10.
b)
El volumen (en mL) de HCl al 36% en masa y densidad 1,20 g·mL–1
necesario para neutralizar 120 mL de la disolución del apartado
anterior.
Masas atómicas (u): H=1,0; O=16,0; Na=23,0; Cl=35,5.
20. Se valoraron 36 mL de una disolución de KOH
con 10 mL de ácido sulfúrico, H2SO4, del 98%
en peso y densidad 1,8 g/mL.
a) ¿Qué concentración, expresada
en g/L, tenía la disolución de hidróxido?
b) Indica el
material de laboratorio necesario para realizar la volumetría.
21. Dada la reacción: HNO3 + H2S
→ NO + S + H2O.
a) Determina si se trata de una
reacción redox y nombra los compuestos que intervienen en la
reacción.
b) Si el rendimiento de la reacción fuera del 75%,
¿cuántos gramos de azufre se obtendrían si se dispone de 200 mL de
HNO3 2,0 M y 2,0 L de H2S en condiciones
estándar.
22. El K2Cr2O7
reacciona con el NaI en medio H2SO4,
produciéndose I2, Na2SO4, Cr2(SO4)3
y H2O.
a) Nombra los compuestos que intervienen en la
reacción.
b) Ajusta la reacción correspondiente por el método
del ión-electrón, indica la naturaleza de las semirreacciones, la
especie reductora y la oxidante.
c) Si 50 mL de una disolucion
de K2Cr2O7, que contiene 25 g/L de
soluto, reaccionan exactamente con 40 mL de una disolución de NaI,
calcula la concentración de esta disolución.
Masas atómicas:
O=16,0; H=1,0; Cr=52,0; K=39,0; I=126,9.
23. La reacción química global de la pila Cu-Zn
se puede escribir: Zn + CuSO4 → Cu + ZnSO4.
Los potenciales normales de reducción son: Zn2+/Zn =
-0,763 V y Cu2+/Cu = 0,337 V. La intensidad de corriente
que circula por esta pila durante una hora es de 45,0 mA. Se pide:
a)
Semirreaciones anódica y catódica y el valor de la fuerza
electromotriz de la pila.
b) La masa de cobre depositada.
c)
La variación de la energía libre de Gibbs.
Datos: Cu = 63,5 u
. 1 Faraday = 96500 culombios mol-1.
24. Teniendo en cuenta los potenciales estándar
siguientes: Zn2+|Zn = -0,76 V; Cu2+|Cu = +0,34
V; Fe2+|Fe = -0,44 V.
a) Deduce, razonadamente, si
los metales cinc, cobre y hierro reaccionarán al añadirlos, cada
uno de ellos por separado, a una disolución ácida con [H+(ac)]=
1 M.
b) Si se dispone de una disolución de Fe2+ de
concentración 1 M, ¿cuál de los otros dos metales permitiría
obtener Fe al introducirlos en esta disolución? Escriba, para este
caso, las semirreacciones de oxidación y de reducción e indique qué
especie se oxida y cuál se reduce.
25. Nombra los siguientes compuestos:
a)
6-etil-6-metil-1,4-octadiíno
b) 2-nitrobutano
c)
4-metil-1,3-pentanodiol
d) fenilpropiléter
e)
2-metilpropanal o isobutanal
f) metilvinilcetona o
3-buten-2-ona
g) ácido propanodioico
h) 2-cloro-butanoato
de etilo
i) metilpropilamina
j) tripropilamina
k)
2-metilpropanamida
l) N,N-dimetilmetanamida
m)
2-etilpentanonitrilo
n) 3-hidroxipentanonitrilo
ñ)
3-aminobutanamida
o) Ácido 2-oxopropanoico
p)
5-hidroxi-2-metil-3oxopentanal
26. Un alcohol tiene una composición centesimal
de 64,87% de C; 13,51% de H y 21,62% de O. Determinar:
a) Su
fórmula empírica.
b) Su fórmula molecular sabiendo que cuando
se vaporizan 18,50 g del alcohol, a 150 °C, ocupan un volumen de 8,8
L a la presión de 750 mm Hg.
c) Proponer dos isómeros de esta
formula y nombrarlos.
27. Escribe las formulas semidesarrolladas e
indique el tipo de isomería que presentan entre sí las siguientes
parejas de compuestos:
a) propanal y propanona
b) but-1-eno
y but-2-eno
c) 2,3-dimetilbutano y 3-metilpentano
d)
etilmetiléter y propan-1-ol
28. Completar indicando el tipo de reacción. Las
reacciones siguientes:
a) CH3-CH=CH2 + H2O
(medio ácido) →
b) C3H8 + O2
→
c) CH2=CH2 + Br2 →
d)
CH3-CH2-CHOH-CH3 (H2SO4/Calor)
→
e) CH3-CH2OH + CH3-COOH
→
f) CH3−CH3 +Cl2 →
g)
CH3−CH2Br + KOH →
h) CH3
−CH2 −CH2Cl + KOH (etanol) →
i)
CH3-COOH + CH3NH2 →
29. El teflón, o politetrafluoroetileno se obtiene por adición del tetrafluoroetileno, o tetrafluoroeteno. Escribe su reacción de polimerización.
30. Al reaccionar el 1,2-etanodiol, o glicol, con
el ácido 1,3-bencenodicarboxílico se obtiene, en una primera etapa,
un éster y agua.
a) Escribe esta reacción y señala de qué
tipo es.
b) Escribe la reacción de formación del poliéster
formado por unión de estos ésteres y, de nuevo, señala el tipo de
reacción.
