IV. CINÉTICA QUÍMICA
1. Velocidad de reacción
1. En la siguiente reacción se halla
experimentalmente que en los primeros 4 segundos han reaccionado 0,20
mol/L de HI:
2HI (g) → I2 (g) + H2
(g).
Determina para estos 4 segundos:
a) La velocidad media
de desaparición de HI.
b) La velocidad media de aparición de
I2.
c) La velocidad media de la reacción.
2. La reacción de oxidación del amoniaco viene
dada por:
4NH3 (g) + 3O2 (g) → 2N2
(g) + 6H2O (g)
Experimentalmente se ha determinado
que la velocidad inicial de obtención de nitrógeno es de 0,40
mol·L-1·s-1.
a) ¿A qué velocidad
desaparece inicialmente el amoniaco?
b) ¿Y el oxígeno?
c)
Calcula la velocidad de reacción inicial.
3. Para cada una de las siguientes reacciones,
expresa la relación entre las velocidades de cambio de productos y
reactivos:
a) 2NO2 (g) → 2NO (g) + O2
(g)
b) 2HOF (g) → 2 HF (g) + O2 (g)
c) 2O3
(g) → 3O2(g)
d) N2 (g) + 3H2
(g) → 2NH3 (g)
2. Mecanismos de reacción
4. Contesta razonadamente:
a) ¿Cómo se
explica que la comida bien masticada facilite la digestión?
b)
¿Qué procedimiento se podría seguir para disminuir bruscamente la
velocidad de una reacción realizada en disolución acuosa?
c)
¿Por qué las limaduras de hierro se oxidan más rápidamente que
una llave de hierro con la misma masa?
d) ¿Cuáles son las
unidades en las que vendrá dada la constante de velocidad para una
reacción a) de primer orden, b) de segundo orden y c) de tercer
orden, cuando las concentraciones se expresan en mol·L–1?
e)
Para la reacción 2NO (g) + 2H2 (g) → N2 (g)
+ 2H2O (g), el mecanismo de reacción es:
2 NO (g) →
N2O2 (g)
N2O2 (g) +
H2 (g) → N2O (g) + H2O (g)
N2O
(g) + H2 (g) → N2 (g) + H2O (g)
Si
la ecuación de velocidad es v = k [NO]2, ¿cuál es la
etapa limitante?
5. Escribe una ley de velocidad para cada una de
las siguientes reacciones elementales y clasifícalas según su
molecularidad:
a) 2NO (g) → N2O2 (g)
b)
Cl2 (g) → 2Cl
c) 2NO2 (g) → NO (g) +
NO3 (g)
6. Se halla experimentalmente para la reacción de
abajo que si se duplica la concentración de óxido de nitrógeno
(V), a una temperatura determinada, la velocidad de reacción es dos
veces mayor.
2N2O5 (g) → 2N2O4
(g) + O2 (g)
a) ¿Cuál es la ecuación de velocidad
para el proceso indicado?
b) ¿Cuál sería la ecuación de
velocidad si la velocidad de reacción fuera 4 veces mayor al
duplicar la concentración de óxido de nitrógeno (V)?
7. Para la reacción en fase gaseosa A+ B → C +
D, cuya ecuación cinética o de velocidad es v = k [A], indica el
orden total de reacción y razona cómo varía la velocidad de
reacción:
a) Al disminuir el volumen del sistema a la mitad.
b)
Al variar las concentraciones de los reactivos sin modificar el
volumen del sistema.
c) Al utilizar un catalizador.
d) Al
aumentar la temperatura.
8. Para la reacción NO(g) + O3 (g) →
NO2 (g) + O2 (g), la ley de velocidad es v = k
[NO] [O3]. Cuando las concentraciones iniciales de NO y O3
son [NO]0=1,0·10–6,
[O3]0=3,0·10–6
(mol·L-1), la velocidad inicial de reacción es 6,6·10-5
mol·L-1·s-1.
a) Indica la molecularidad,
el orden de reacción y los órdenes parciales.
b) Determina las
unidades de la constante de velocidad.
c) Calcula su valor.
d)
Calcula la velocidad inicial de la reacción si las concentraciones
iniciales de NO y O3 fueran, respectivamente, 3,0·10-6
y 9,0·10-6 mol·L-1.
3. Teoría del estado de
transición
9. El peróxido de hidrógeno (H2O2),
llamado también agua oxigenada, se descompone muy lentamente en
disolución acuosa en oxígeno y agua. La reacción de descomposición
se ve facilitada cuando se añaden iones yoduro, y sigue el siguiente
mecanismo:
Etapa 1: H2O2 (ac) + I−
(ac) → H2O (l) + IO− (ac)
Etapa 2:
H2O2 (ac) + IO − (ac) → H2O
(l) + O2 (g) + I − (ac)
Cuando se estudia
experimentalmente este mecanismo se encuentra que la etapa 1 es la
más lenta y, por lo tanto, la reacción global sigue una cinética
de orden 1 respecto al peróxido de hidrógeno y de orden 1 respecto
al ion yoduro.
a) Escribe la ecuación de velocidad de la
reacción de descomposición del peróxido de hidrógeno en presencia
de iones yoduro e indique cuál es el orden total de la reacción.
Explica razonadamente qué función tienen los iones yoduro en este
proceso de descomposición y con qué unidades se expresa la
constante de velocidad de esta reacción.
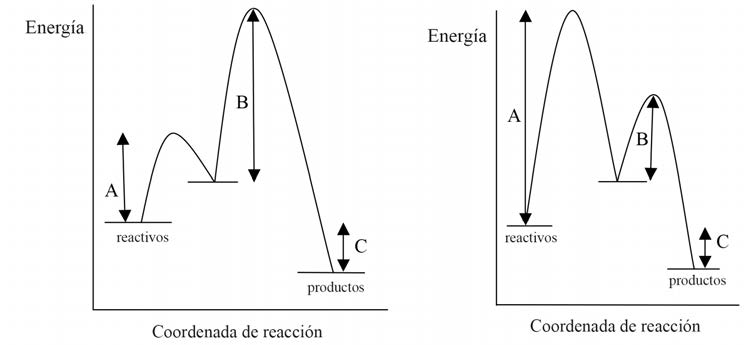
b) ¿Cuál de las dos
figuras siguientes representa mejor la descomposición del peróxido
de hidrógeno en presencia de iones yoduro y qué magnitudes
representan las letras A, B y C? Desde el punto de vista energético,
¿la descomposición es exotérmica o endotérmica? Argumenta las
respuestas.
10.
Contesta razonadamente:
a) ¿Es cierto que las reacciones muy
exotérmicas no necesiten energía de activación?
b) ¿Por qué
una mezcla de butano y aire pueden permanecer sin reaccionar pero
basta que salte una chispa para provocar una reacción rápida o,
incluso, una explosión?
c) ¿Cómo se explica que un
catalizador aumente la velocidad de reacción?
d) Indica cuál
de los diagramas entálpicos de arriba corresponde a una reacción
endotérmica.
e) ¿Es posible cambiar la constante de velocidad
de una reacción cambiando la temperatura?
f) ¿Es cierto que,
si evoluciona a temperatura constante, la velocidad de una reacción
de primer orden permanece constante?
g) ¿Es cierto que, si
evoluciona a temperatura constante, la constante de velocidad de una
reacción de primer orden permanece constante?
h) ¿De qué
orden debe ser una reacción para que su velocidad permanezca
constante durante todo el proceso a temperatura constante?


