1. Explica, según la Teoría atómica de Dalton, qué es un compuesto químico y en qué se diferencia de un elemento químico.
2. Cuando se calientan 50 g de carbonato de
calcio, tiene lugar una reacción química que produce 28 g de óxido
de calcio y cierta cantidad de dióxido de carbono. Sabiendo que el
carbonato de calcio está compuesto por un átomo de calcio, otro de
carbono y tres de hidrógeno (CaCO3), y que el óxido de
calcio está compuesto por un átomo de calcio y otro de oxígeno
(CaO), determina y justifica de acuerdo con la Teoría atómica de
Dalton:
a) De qué está compuesto el dióxido de carbono y su
fórmula química.
b) La masa de dióxido de carbono producida.
3. Thomson consiguió determinar la proporción en
que se encuentran la carga del electrón y su masa, en valor
absoluto, 1,76·1011 C/Kg. A partir de los datos dados
sobre la estructura atómica:
a) Determina la masa del
electrón.
b) Determina la masa del protón.
c) Determina
la masa del neutrón.
d) Repite el ejercicio utilizando una hoja
de cálculo.
d) Compara los resultados obtenidos con datos
fiables que encuentres en internet.
4. El sistema solar tiene 8 planetas conocidos que
se consideren como tales, Mercurio es el primero y Neptuno, el
último. El átomo de oxígeno tiene 8 electrones que, según el
modelo de Rutherford, orbitan alrededor de su núcleo. Busca en
internet datos fiables para:
a) El radio del Sol y el radio
medio de la órbita de Neptuno.
b) El radio del núcleo de
oxígeno y su radio atómico.
c) Utiliza estos datos para hacer
un estudio comparativo del vacío en el sistema solar y el vacío en
el átomo.
5. ¿Por qué se dice que el modelo atómico de Bohr es un modelo planetario?
6. El electrón de cierto átomo puede excitarse,
por ejemplo, de la órbita 1 a la 3. Contesta razonadamente a las
siguientes preguntas:
a) ¿Absorbe o emite luz?
b) ¿Cuántas
órbitas intermedias hay entre estas dos?
c) ¿Cuántos
electrones pueden encontrarse en la órbita 1? ¿Y en la 3?
7. Observa aquí
los espectros de absorción y emisión del nitrógeno y el
oxígeno.
a) ¿Los espectros de absorción son iguales para los
dos elementos?
b) ¿Qué similitudes encuentras entre los
espectros de absorción y emisión del oxígeno?
8. Cierto átomo neutro tiene 10 protones y 11
neutrones. Razona la veracidad o falsedad de las siguientes
proposiciones:
a) Su número atómico es 10; i.e., Z=10.
b)
Su número másico es 11; i.e., A=11.
c) Tiene 10 protones en la
corteza.
d) Tiene 11 electrones.
9. Indica si son posibles las siguientes especies
químicas, con la ayuda de la tabla
periódica.
a) 42Fe
b)2656Fe
c)
5626Fe
d)42He
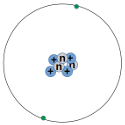
10. Se ilustra a continuación el átomo de un determinado elemento según el modelo de Bohr. Indica: Z, A, si es neutro y de qué elemento se trata:

11. Representa átomos con las siguientes
características:
a) Z=20 y número de neutrones=20
b)
Cl-35; i.e., Cloro con A=35
c) Na-25
d) A=20 y Z=10
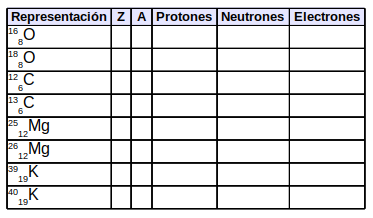
12. Completa la siguiente tabla:
13. El 75,8% del cloro que se encuentra en la naturaleza es Cl-35 (35Cl); el resto, prácticamente, es Cl-37 (37Cl). Calcula la masa atómica del cloro.
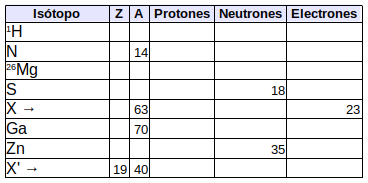
14. Completa la siguiente tabla con ayuda de la tabla periódica:
15. Algunos isótopos presentes en la naturaleza
son inestables; es decir, tienden espontáneamente a transformarse en
isótopos más estables incluso de elementos distintos. Estas
transformaciones tienen lugar en el núcleo, son, por tanto,
reacciones nucleares, y vienen acompañadas de la emisión, o
radiación, de partículas. A estos isótopos inestables se les llama
radiactivos.
Las partículas emitidas son de tres tipos:
-
Partículas α (alfa): Son núcleos de He-4 (42He).
-
Partículas β (beta):
Son electrones (e - = β
-) o
positrones (e+ = β+).
Estos últimos son partículas con la misma masa que los electrones
pero con carga positiva.
- Partículas γ
(gamma): Son fotones, es decir, cuantos o paquetes de luz, de energía
muy alta, no visible con nuestros ojos.
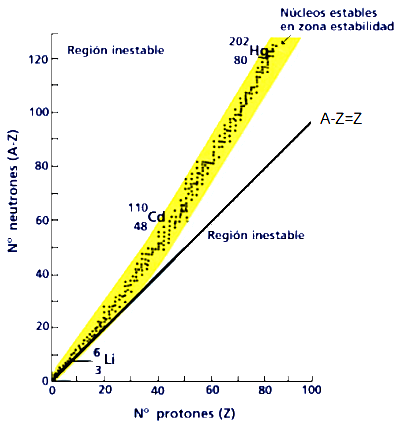
La
gráfica número de protones (Z)-número de neutrones (A-Z) de arriba
representa los isótopos estables; se le llama cinturón, zona o
franja de estabilidad. Un isótopo que no se encuentre en el cinturón
de estabilidad es inestable y emitirá radiación hasta
alcanzarlo.
Se llama familia o serie radiactiva al conjunto de
isótopos que forman parte del proceso a través del cual un isótopo
inestable, o radiactivo, alcanza el cinturón de estabilidad, es
decir, se convierte en un isótopo estable. Por ejemplo, la serie
radiactiva del uranio-238, también llamada serie del radio es la
siguiente:
23892U → 23490Th
→ 23491Pa → 23492U →
23090Th → 22688Ra →
22286Rn → 21884Po →
21885At → 21483Bi →
21081Tl → 21082Pb →
21083Bi → 21084Po →
20682Pb
En la desintegración radiactiva
del U-238 se emite una partícula α:
23892U → 23490Th +
42He
En la desintegración del Th-234 se
emite una partícula β
-:
23490Th → 23491Pa
+ 0-1e
En estos procesos de desintegración
los núcleos producidos se encuentran en estados excitados. Igual que
los electrones del átomo excitados tienden a decaer a niveles de
menor energía y emiten luz, los nucleones excitados decaen emitiendo
luz. Estos fotones emitidos son las partículas γ,
fotones mucho más energéticos que los emitidos en los decaimientos
atómicos. En el proceso de abajo se representa el estado
excitado con un asterisco:
23491Pa* →
23491Pa + γ
-
Contesta razonadamente a las siguientes preguntas:
a)
Observa el proceso de desintegración del U-238. ¿Qué relación
encuentras entre los números másicos y atómicos de los isótopos
iniciales (reactivos) y finales (productos) de la reacción
nuclear?
b) En la desintegración del Th-234 se ha representado
a la partícula β
-, al electrón, como 0-1e. ¿Qué
sentido tiene atribuirle al electrón el número másico 0 y el
atómico -1?
c) En la desintegración β
- del
23490Th se produce 23491Pa;
es decir, se conserva el número másico (234) pero aumenta el número
atómico (90 → 91). ¿Qué ha ocurrido con los nucleones del
Th-234?
d) ¿Cómo crees que se representará una partícula β+,
es decir, un positrón?
e) El He-3 es un isótopo estable del He
aunque poco frecuente en la naturaleza. ¿Qué isótopo se produciría
en una desintegración β+
del He-3? ¿Qué ha ocurrido con los nucleones del He-3 en este
proceso?
f) Deduce los tipos de desintegraciones que tienen
lugar en la serie radiactiva del U-238.
g) ¿Por qué se detiene
la cadena en el Pb-206?
- Busca información en distintas
fuentes y realiza una presentación que trate uno de los siguientes
temas:
h) Peligro para la salud de las emisiones radiactivas.
i)
Aplicaciones técnicas de los isótopos radiactivos y las reacciones
nucleares.
j) Residuos radiactivos. Importancia de su gestión.
16. Ordena los siguientes átomos de menor a mayor
número de electrones con ayuda de la tabla
periódica:
N3-, O2-, F -,
Ne, Na+, Mg2+, Al3+.
17. Indica cuántos electrones debe ganar o perder
el elemento para tener tantos como el gas
noble con número atómico más cercano:
a) O
b) S
c)
Se
d) Be
e) Mg
f) Ca
g) F
h) Cl
i)
Br
j) B
k) Al
l) Li
m) Na
n) K
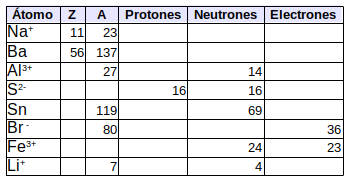
18. Completa la siguiente tabla:
19. Un cuerpo presenta una carga de 5,0 C.
a)
¿Ha perdido o ganado electrones?
b) ¿Cuántos?
20. Otro cuerpo presenta una carga de -2,00 μC.
a)
¿Ha ganado o perdido electrones?
b) ¿Cuántos?
