6. En la figura de abajo se representa la estructura del NaCl en estado sólido, formado por una red de cationes Na+ y aniones Cl -.
1. Hay un cuarto estado de agregación de la materia que no hemos contemplado en nuestro estudio, el plasma. Busca información sobre este estado y escribe qué le caracteriza y en qué se diferencia de los estados sólido, líquido y gaseoso.
2. ¿Son equivalentes la unidades de densidad Kg/m3 y g/L?, ¿y g/cm3 y g/mL?
3. Se tiene un prisma metálico de dimensiones: 10,0x6,0x2,0 cm3. Su masa es igual a 852,0 g. Calcula la densidad del metal y, con ayuda de la tabla periódica, determina de qué metal se trata.
4. La densidad del níquel es 8,9 Kg/L.
a)
Calcula la masa de un bloque de níquel que ocupa 2,0 litros.
b)
Calcula el volumen de un bloque de níquel de 17,8 Kg.
c)
Calcula la densidad del níquel en g/L y en g/cm3.
5. El agua es una molécula polar; es decir, presenta un lado con carga eléctrica negativa y otro con carga positiva; no le ocurre lo mismo a la molécula de dióxido de carbono, que no presenta polaridad. Busca en internet las temperaturas de fusión de estas dos especies químicas y trata de explicar que exista tanta diferencia entre ellas.

6.
En la figura de abajo se representa la estructura del NaCl en estado
sólido, formado por una red de cationes Na+ y aniones Cl
-.
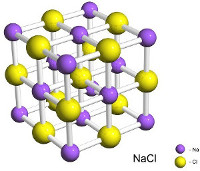
a)
¿Crees que las temperaturas de fusión y ebullición del NaCl son
altas o bajas? Razona tu respuesta.
b) Describe cómo el cristal
de NaCl se funde de acuerdo con la Teoría cinética de la materia.
7. Determina la presión que ejerce una fuerza de 100 N sobre una superficie de 4,0 m2 en Pa y atm.
8. Se llaman condiciones normales a una presión de 1 atm y una temperatura de 0 ºC; condiciones estándar, a una presión de 1 atm y una temperatura de 25 ºC. En estas condiciones ¿cuánto es el valor de la temperatura absoluta?
9. En un recipiente de 5,0 litros se introduce gas oxígeno (O2) a una presión de 4,00 atm. ¿Qué presión ejercerá el gas en un volumen de 10 litros si la temperatura permanece constante?
10. En un recipiente de 5,0 litros se introduce gas oxígeno (O2) a una presión de 3,0 atm y se observa que su temperatura es 27 ºC. ¿Cuál será su presión si la temperatura pasa a ser de 127 ºC sin que varíe el volumen?
11. Un globo tiene un volumen de 4,0 L de aire a 27 ºC. Se le escapa a un niño y sube a dos kilómetros de altura, donde la temperatura es de -5,0 ºC ¿Cual será ahora el volumen del globo suponiendo la misma presión?
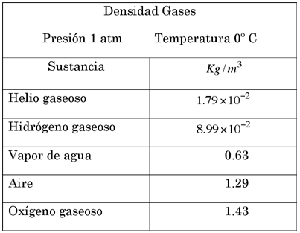
12. Las tablas de densidades de las sustancias gaseosas indican las condiciones de presión y temperatura en que se han medido. ¿A qué se debe esto?
13.
La reacción de formación del metano es (sin ajustar): C (s) + H2
(g) → CH4 (g).
a) ¿Cuántos litros de metano en
condiciones normales (0 ºC y 1 atm) se forman a partir de 120,0 g de
carbono?
b) ¿Y en condiciones estándar (25 ºC y 1 atm)?
c)
¿En condiciones normales, cuántos litros de H2 se
necesitan para reaccionar con un fragmento de carbono de 12,0 cm3
de volumen?
Datos: Masas atómicas: C = 12,0 u; H = 1,0 u;
Densidad del C = 2,3 g/cm3.
14. La reacción de combustión del butano es (sin
ajustar):
C4H10 (g) + O2 (g) →
CO2 (g) + H2O (l)
Esta reacción es muy
exotérmica, es decir, desprende mucho calor; de aquí que sea la
reacción que se provoca en ciertos calentadores de agua. En estos
calentadores se utilizan bombonas de butano que contienen 12,5 Kg de
este gas.
a) ¿Cuánto ocuparía el gas en condiciones
estándar?
b) ¿Qué volumen de dióxido de carbono se desprende
en la combustión de los 12,5 Kg de butano en condiciones
estándar?
Datos.
15. El amoniaco se produce según la reacción
(sin ajustar): N2 (g) + H2 (g) → NH3
(g). Si se dispone de 2240 L de N2 en condiciones
normales:
a) ¿Cuántos litros de H2 son necesarios
para reaccionar con todo el nitrógeno?
b) ¿Cuántos litros de
NH3 se obtienen?
Datos.
