Unidad 5. DISOLUCIONES
1. Mezclas
1. Se dispone de una mezcla homogénea de H2O,
KCl y NaOH.
a) Nombra las tres especies químicas.
b) ¿Cuál
de las tres es el disolvente?
c) ¿Cuál es el soluto?
d)
¿Qué compone la disolución?
e) ¿La masa de la disolución es
igual a la suma de las masas de los componentes por separado?
f)
¿El volumen de la disolución es igual a la suma de los volúmenes
de los componentes por separado?
2. Se dispone de una disolución de ácido
clorhídrico, HCl, con una densidad de 1,18 g/cm3.
a) Calcula la masa de 100 mL de disolución.
b) Calcula el volumen en litros que ocupan 100 g de disolución.
3. La densidad del Mar Muerto es de 1240 Kg/m3.
a)
Calcula su densidad en Kg/L y en g/l.
b) Calcula la masa de 250
mL de agua del Mar Muerto.
c) Calcula el volumen que ocupa 1,00
Kg de agua del Mar Muerto.
2. Concentración de disoluciones
4. ¿Cuántos gramos de sal común se necesitan
para preparar 150 cm3 de disolución de NaCl con
concentración 1,5 g/L?
5. Para soldar se utiliza una aleación de estaño
y plomo. El tanto por ciento en masa del plomo es 66%. Si se quiere
preparar 2,0 Kg de esta aleación, ¿qué masa de plomo y de estaño
se necesitan?
6. ¿Cuántos gramos de ácido sulfúrico, H2SO4,
hay en 100 mL de una disolución 0,20 M de este ácido?
7. En el laboratorio disponemos de un ácido
clorhídrico al 40% con densidad 1,190 g/cm3.
a) ¿Qué
masa tiene un litro de esta disolución?
b) ¿Cuántos moles de
HCl hay en 100 mL de esta disolución?
8. El cloruro de sodio en el mar tiene una
concentración de 28,5 Kg/m3.
a) Suponiendo que la
densidad del agua de mar es de 1030 Kg/m3, ¿cuántos
gramos de sal hay en 1,00 L de agua de mar?
b) ¿Y en 1,00 Kg de
agua de mar?
9. Se quieren preparar 100 mL de disolución al
10% en volumen de alcohol etílico (etanol, CH3-CH2OH)?
Sabiendo que la densidad del etanol puro es de 0,789 g/cm3,
calcula la masa de etanol necesaria para preparar la disolución.
10. Se quieren preparar 100 mL de disolución de
ácido nítrico (HNO3) 0,10 M. Si disponemos de ácido
nítrico 1,00 M en el laboratorio, ¿cuántos litros de esta
disolución necesitamos?
3. Preparación de disoluciones
11. ¿Cómo prepararías la disolución del
ejercicio 4?
12. ¿Cómo prepararías la disolución del
ejercicio 10?
13. Una pieza de Zn(s) de 1,96 g reacciona con
H2SO4 0,275 M, en la reacción:
Zn (s) +
H2SO4 (ac) → ZnSO4 (s) + H2
(g)
a) Calcula el volumen de disolución de ácido sulfúrico
(H2SO4) necesario para completar la
reacción.
b) ¿Qué volumen de hidrógeno medido en condiciones
estándar se obtendrá?
c) Calcula la masa de sulfato de cinc,
ZnSO4, obtenido.
14. En una etiqueta de H2SO4
se encuentran los siguientes datos: 1,84 g/mL (densidad); 96%.
Calcula el volumen de una disolución de NaOH, de concentración
2,00 M necesarios para reaccionar con 10 mL del ácido
sulfúrico.
Reacción (sin ajustar): H2SO4
+ NaOH → Na2SO4 + H2O.
4. Solubilidad
15. A partir de la siguiente gráfica, que muestra
la solubilidad de las sales indicadas por cada 100 g de agua en
función de la temperatura, determina:
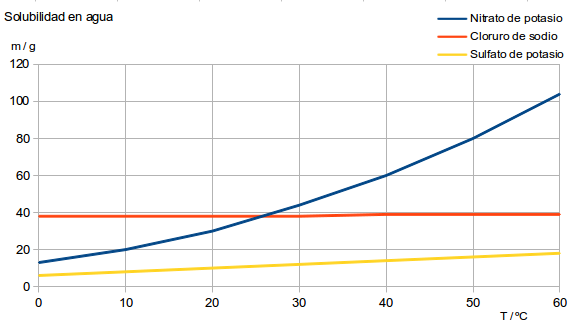
a)
¿Qué solubilidad tiene el nitrato de potasio, KNO3, a 50
ºC?
b) Calcula la solubilidad en porcentaje en masa del KNO3
a 40 ºC.
b) ¿Qué masa de KNO3 se disolverá en 1,0
Kg de agua a 50 ºC?
c) ¿Qué masa de agua se necesita para
disolver 200 g de KNO3 a 40 ºC?
d) ¿A qué
temperatura tiene el KNO3 una solubilidad de 20g/100 g de
agua?
e) ¿Qué masa de KNO3 precipita si una
disolución saturada con 100 g de agua a 50 ºC se enfría hasta 20
ºC?
f) ¿Y si la disolución saturada tiene 250 g de agua?


