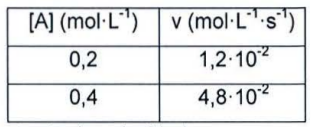
b) Calcular el valor y unidades de la constante de velocidad.
3. En el laboratorio se dispone de una botella con la siguiente etiqueta: Acido nítrico -trioxonitrato (V) de hidrógeno -hidróxidodióxido nitrógeno- (HNO3), 40% en masa; densidad. 1,42 kg·L-1. Determinar:
a) El pH de la disolución obtenida tomando 1 mL del contenido de la botella y añadiendo agua hasta completar un volumen total de 100 mL.
b) Si se toman 55 mL de ésta disolución y se le añade gota a gota disolución 0,05 M de NaOH con fenolftaleína como indicador, ¿qué volumen de ésta disolución será necesario para neutralizar el ácido?
Masas atómicas (u): H=1,N=14, O=16.
4. La KPS del carbonato de plata -trioxocarbonato (IV) de plata- (Ag2CO3) es 4,8·10-12. Hallar, en g·L-1:
a) La solubilidad del carbonato de plata en agua pura.
b) La solubilidad del carbonato de plata en presencia de una disolución 0,2 mol·L-1 de carbonato potásico -trioxocarbonato (IV) de potasio- (K2CO3).
Masas atómicas (u): C=12, O=16, Ag=108.
b) Explicar las isomerizaciones de cadena, de posición y de función.
c) Proponer un ejemplo de cada una de ellas, nombrando todos los compuestos utilizados.
Repertorio B
1. Dada la molécula de BeCl2, indicar, razonadamente:
a) Tipo de hibridación del átomo de berilio.
b) Polaridad de los enlaces y polaridad de la molécula.
c) Indicar dos propiedades de las moléculas covalentes.
2. En un recipiente de 750 mL se introducen 0,1 mol de N2O4(g) y, cuando la temperatura es de 50 ºC, se establece el equilibrio:
N2O4(g) ⇄ 2NO2(g), siendo la presión total de 4,2 atm. Calcular:
a) Kc y Kp.
b) El grado de disociación, en %, del N2O4(g).
R=0, 082 atm·L·mol-1·K-1.
3. a) Indicar, razonadamente, si las siguientes sustancias son ácidas, básicas o anfóteras en su reacción con el agua, según la teoría de Brönsted-Lowry: 1) S2-; 2) HCO3-; 3) HS- y 4) CO32-.
b) Determinar el pH de una disolución acuosa de amoniaco 0,05 M, si Kb=1,8·10-5.
4. Se intenta construir una pila galvánica cuyo cátodo sea el electrodo Pb2+/Pb; para ello. se tiene otros dos electrodos: Ag+/Ag y Zn2+/Zn.
a) Razonar cuál de estos dos electrodos se puede usar como ánodo.
b) Indicar en esquema la pila formada y calcular su fuerza electromotriz estándar.
Potenciales normales de electrodo (V): EºAg+/Ag =+0, 80; EºPb2+/Pb =-0, 13; EºZn2+/Zn =-0,76.
5. Explicar cómo reacciona el propeno con las siguientes sustancias, nombrando los productos obtenidos.
a) Cl2; b) HCI y c) H2O (en medio ácido, H2SO4).